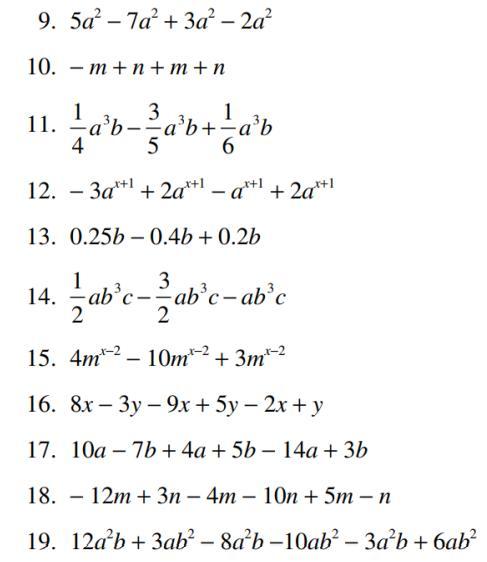Se calientan 305 g Mol de clorato de potasio hasta que se libera todo el oxigeno de las moléculas. El oxigeno así obtenido se usa para oxidar paladio y producir oxido paládico ¿Cuántos gramos del oxido se forman? tengo la siguiente respuesta pero no estoy segura de ella: Si se calientan 305 g Mol de clorato potásico hasta que se libera todo el oxígeno, entonces la cantidad de oxígeno producido será (305 g Mol) * (1 Mol KClO3/122,55 g KClO3) * (3 Mol O2/1 Mol KClO3) = 14,82 Mol O2. Como el paladio se oxida para formar óxido de paladio, y cada dos moles de oxígeno producen un mol de óxido de paladio, entonces el número de moles de óxido de paladio formado será 14,82/2 = 7,41 Mol PdO. Utilizando la masa molar del óxido de paladio (223,2 g/mol), el número de gramos de óxido de paladio producidos es (7,41 Mol PdO) * (223,2 g/mol) = 1664,6 g PdO. porfa aclarenme la duda
Respuestas 1
Respuesta:
cómo q te faltó agregar más cosas
por q así no se entiende
-
Autor/a:
foxychandler
-
Califica una respuesta:
3
¿Conoces la respuesta? Añádela aquí
Escoger idioma y región
How much to ban the user?
1 hour
1 day
100 years