Qué porciento es 275 de 2800
-
Materia:
Matemáticas -
Autor/a:
yair -
Creada:
hace 1 año
Respuestas 1
Respuesta:
9.8%
Explicación paso a paso:
te dejo procedimiento en la imagen, espero este bien
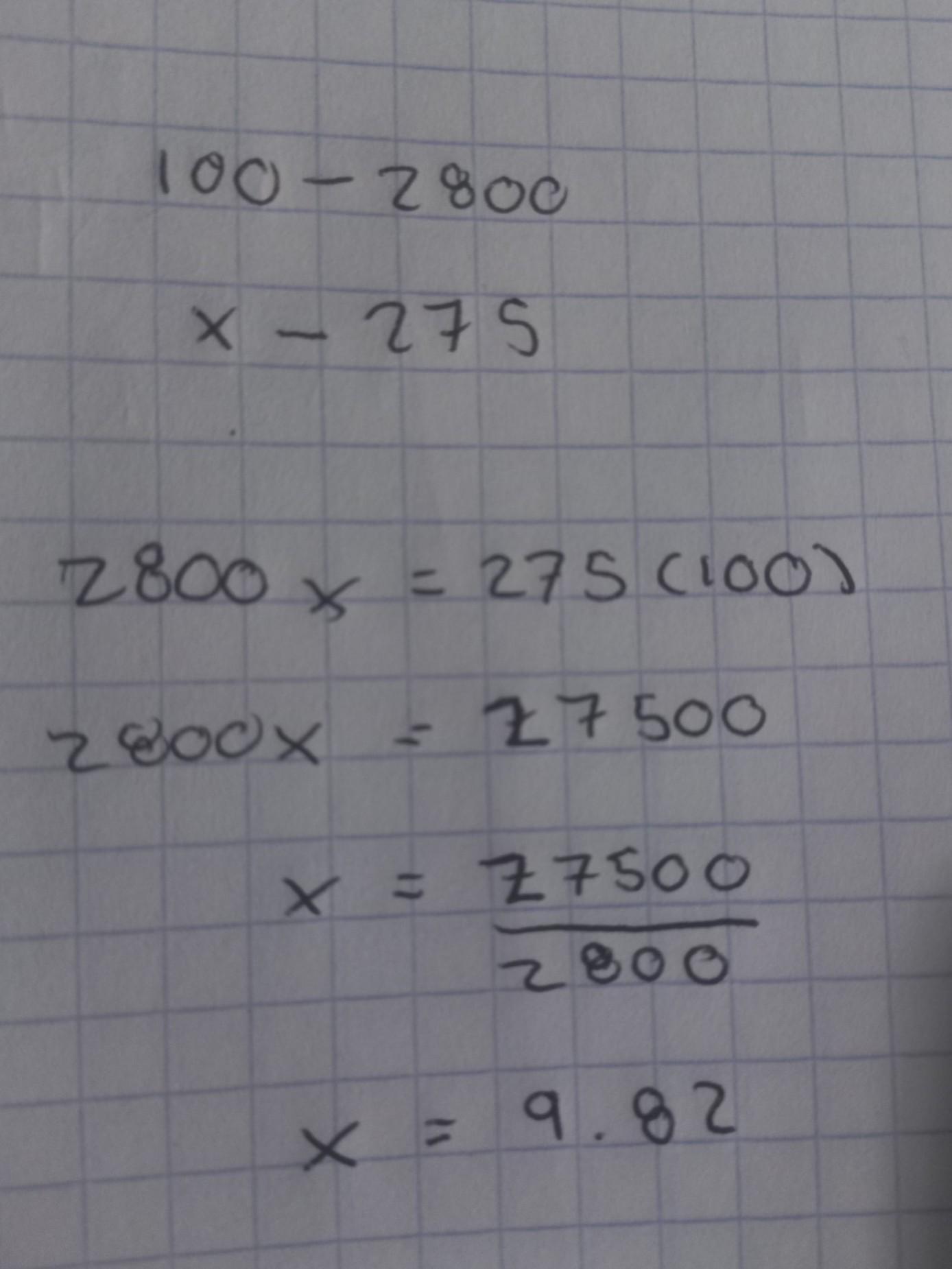
-
Autor/a:
airesmartinez
-
Califica una respuesta:
10
¿Conoces la respuesta? Añádela aquí
Escoger idioma y región
How much to ban the user?
1 hour
1 day
100 years

